ELABORACIÓN SALSA AGRIDULCE
PRACTICA # 20
GRUPO #2
Agroindustria
miércoles, 31 de agosto de 2016
jueves, 25 de agosto de 2016
ELECTROLITOS, ELECTROLISIS Y EQUILIBRIO QUÍMICO
PRACTICA # 17
PRESENTADO POR : GRUPO: # 2
OBJETIVO GENERAL:
* Identificar como aplicar una corriente eléctrica al agua, se puede descomponer en los elementos que la conforman.
OBJETIVO ESPECIFICO:
* Verificar que o cuales elementos pueden descomponerse al aplicarle al agua una corriente eléctrica.
MATERIALES
FUNDAMENTACION TEÓRICA
La electrólisis o electrolisis es el proceso que separa los elementos de un compuesto por medio de la electricidad. En ella ocurre la captura de electrones por los cationes en el cátodo (una reducción) y la liberación de electrones por los aniones en el ánodo (una oxidación).
Electrólisis o Electrolisis proceso que separa los elementos de un compuesto por medio de la electricidad. Ciertas sustancias, (ácidos, hidróxidos, sales y algunos óxidos metálicos disueltos o fundidos) son conductores de electricidad al mismo tiempo que se descomponen al paso de la corriente eléctrica, a estas sustancias se les llama electrolitos. A tal fenómeno se le denomina electrólisis y constituye fundamentalmente un proceso de oxidación reducción que se desarrolla "no espontáneamente" es decir, un conjunto de transformaciones que implican un aumento de energía libre del sistema, y por ende, requiere para su realización el concurso de una fuerza externa de energía.
Las reacciones que tienen lugar en los electrodos de la electrólisis están en general determinadas por leyes energéticas, así como en lapila, la reacción en cada electrodo es la que corresponde a una reacción que produzca la máxima disminución de energía libre, en la electrólisis se producirán las reacciones que correspondan a una reacción total que produzca el mínimo aumento de energía libre. En el caso de electrólisis de sales fundidas como el Cloruro de sodio (NaCl), en el cátodo solo puede verificarse una reacción que es la reducción de los iones Sodio (Na) pues el ión Cloro (Cl) solo puede oxidarse, y en el ánodo se produce la oxidación de los iones Cloro (Cl) , pues elSodio (Na) solo puede reducirse.
Las reacciones que tienen lugar en los electrodos de la electrólisis están en general determinadas por leyes energéticas, así como en lapila, la reacción en cada electrodo es la que corresponde a una reacción que produzca la máxima disminución de energía libre, en la electrólisis se producirán las reacciones que correspondan a una reacción total que produzca el mínimo aumento de energía libre. En el caso de electrólisis de sales fundidas como el Cloruro de sodio (NaCl), en el cátodo solo puede verificarse una reacción que es la reducción de los iones Sodio (Na) pues el ión Cloro (Cl) solo puede oxidarse, y en el ánodo se produce la oxidación de los iones Cloro (Cl) , pues elSodio (Na) solo puede reducirse.
DIAGRAMA DE FLUJO
DISCUSIÓN DE RESULTADOS
1 ¿ Porque la corriente eléctrica descompone el agua en hidrógeno y oxigeno?
Esto es conocido como la electrolisis del agua es la descomposición del agua (H2O9 los gases oxigeno (O7) , Hidrógeno (H) , por medio de una corriente eléctrica a través del agua acidulada . De tal manera que la descomposición del agua la podemos comparar efectuando la electrolisis de dichas sustancias, esto se debe al conjunto de fenómenos químicos que pasa cuando hay una corriente eléctrica.
2 ¿ Que es el electrodo ?
Es el extremo de un conductor en contacto con un medio, al que lleva a el que recibe una corriente eléctrica especialmente con una parte no metabólica de un circuito ( el semiconductor)
3 ¿ porque el oxigeno y el hidrógeno se obtienen en estado gaseoso?
Porque a temperatura ambiente son gases y sus átomos se disponen en moléculas biatomicas . El oxigeno s obtiene comprimiendo , el liquido es ligeramente soluble en agua .
El hidrógeno solo se encuentra en grandes cantidades en la atmósfera, se obtiene de ácidos diluido sobre los metales , es un gas incoloro.
4 ¿ Que otros compuestos se pueden descomponer por medio de la electrolisis?
Sulfato de sodio , sulfato de cobre , cloruro de sodio , cloruro de bario, hidróxido de sodio y principalmente el sulfato de cobre.
5 ¿ Porque una solución salina conduce la corriente eléctrica?
Porque son electrolitos , los electrolitos son aquellas sustancias que al diluirse en el agua permiten el paso de corriente eléctrica.
Uno de los electrolitos mas utilizados es la sal común de sodio ( NaCl)
CONCLUSIONES
PARTE # 2
EXPERIMENTO ( REACCIONES DE OXIDO - REDUCCIÓN Y CELDAS ELECTROLÍTICAS)
OBJETIVO GENERAL :
* Construir una pila casera
OBJETIVO ESPECIFICO:
* Emplear la pila casera para hacer funcionar un dispositivo electrónico de baja potencia.
MATERIALES
DISCUSIÓN DE RESULTADOS
1 ¿ Porque la papaya y el limón funcionan como celdas electrolíticos?
Una de sus razones es por el ácido que contiene cada uno por los iones en el jugo.
2 ¿ Que reacciones ocurren en el cátodo y en el ánodo?
Cátodo: Es un electrodo con carga negativa que sufre una reaccion de reduccion mediante la cual un material reduce su estado de oxidación al recibir electrones.
Ánodo: Es un electrodo en el cual se produce una reaccion de oxidación mediante la cual un material al perder electrones incrementa su estado de oxidación
3 ¿ Como puedes hacer una apreciación cuantitativa de la energía eléctrica producida en este proceso?
Esto se puede cuantificar mediante un conducto metro que tiene el pHimetro en el laboratorio y también por el tiempo que permanece.
4 ¿ Porque algunas reacciones químicas generan energía eléctrica?
Porque son exotermicas.
CONCLUSIONES
PRACTICA # 17
PRESENTADO POR : GRUPO: # 2
OBJETIVO GENERAL:
* Identificar como aplicar una corriente eléctrica al agua, se puede descomponer en los elementos que la conforman.
OBJETIVO ESPECIFICO:
* Verificar que o cuales elementos pueden descomponerse al aplicarle al agua una corriente eléctrica.
MATERIALES
- Monedas
- Ganchos clip
- 1 Vaso de precipitados de 250 ml
- 2 Cables de cobre con pinzas caiman de 30 cm de largo
- 1 Pila cuadrada de 9 voltios
- 2 Lapices con mina de grafito
- Laminas de cobre de 1 por 4 cm
- 1 carton de 10 cm por 10 cm
- 1 Cucharita
REACTIVOS
- Agua
- Cloruro de sodio NaCl
La electrólisis o electrolisis es el proceso que separa los elementos de un compuesto por medio de la electricidad. En ella ocurre la captura de electrones por los cationes en el cátodo (una reducción) y la liberación de electrones por los aniones en el ánodo (una oxidación).
Electrólisis o Electrolisis proceso que separa los elementos de un compuesto por medio de la electricidad. Ciertas sustancias, (ácidos, hidróxidos, sales y algunos óxidos metálicos disueltos o fundidos) son conductores de electricidad al mismo tiempo que se descomponen al paso de la corriente eléctrica, a estas sustancias se les llama electrolitos. A tal fenómeno se le denomina electrólisis y constituye fundamentalmente un proceso de oxidación reducción que se desarrolla "no espontáneamente" es decir, un conjunto de transformaciones que implican un aumento de energía libre del sistema, y por ende, requiere para su realización el concurso de una fuerza externa de energía.
Las reacciones que tienen lugar en los electrodos de la electrólisis están en general determinadas por leyes energéticas, así como en lapila, la reacción en cada electrodo es la que corresponde a una reacción que produzca la máxima disminución de energía libre, en la electrólisis se producirán las reacciones que correspondan a una reacción total que produzca el mínimo aumento de energía libre. En el caso de electrólisis de sales fundidas como el Cloruro de sodio (NaCl), en el cátodo solo puede verificarse una reacción que es la reducción de los iones Sodio (Na) pues el ión Cloro (Cl) solo puede oxidarse, y en el ánodo se produce la oxidación de los iones Cloro (Cl) , pues elSodio (Na) solo puede reducirse.
Las reacciones que tienen lugar en los electrodos de la electrólisis están en general determinadas por leyes energéticas, así como en lapila, la reacción en cada electrodo es la que corresponde a una reacción que produzca la máxima disminución de energía libre, en la electrólisis se producirán las reacciones que correspondan a una reacción total que produzca el mínimo aumento de energía libre. En el caso de electrólisis de sales fundidas como el Cloruro de sodio (NaCl), en el cátodo solo puede verificarse una reacción que es la reducción de los iones Sodio (Na) pues el ión Cloro (Cl) solo puede oxidarse, y en el ánodo se produce la oxidación de los iones Cloro (Cl) , pues elSodio (Na) solo puede reducirse.
DIAGRAMA DE FLUJO
DISCUSIÓN DE RESULTADOS
1 ¿ Porque la corriente eléctrica descompone el agua en hidrógeno y oxigeno?
Esto es conocido como la electrolisis del agua es la descomposición del agua (H2O9 los gases oxigeno (O7) , Hidrógeno (H) , por medio de una corriente eléctrica a través del agua acidulada . De tal manera que la descomposición del agua la podemos comparar efectuando la electrolisis de dichas sustancias, esto se debe al conjunto de fenómenos químicos que pasa cuando hay una corriente eléctrica.
2 ¿ Que es el electrodo ?
Es el extremo de un conductor en contacto con un medio, al que lleva a el que recibe una corriente eléctrica especialmente con una parte no metabólica de un circuito ( el semiconductor)
3 ¿ porque el oxigeno y el hidrógeno se obtienen en estado gaseoso?
Porque a temperatura ambiente son gases y sus átomos se disponen en moléculas biatomicas . El oxigeno s obtiene comprimiendo , el liquido es ligeramente soluble en agua .
El hidrógeno solo se encuentra en grandes cantidades en la atmósfera, se obtiene de ácidos diluido sobre los metales , es un gas incoloro.
4 ¿ Que otros compuestos se pueden descomponer por medio de la electrolisis?
Sulfato de sodio , sulfato de cobre , cloruro de sodio , cloruro de bario, hidróxido de sodio y principalmente el sulfato de cobre.
5 ¿ Porque una solución salina conduce la corriente eléctrica?
Porque son electrolitos , los electrolitos son aquellas sustancias que al diluirse en el agua permiten el paso de corriente eléctrica.
Uno de los electrolitos mas utilizados es la sal común de sodio ( NaCl)
CONCLUSIONES
- Principalmente realizamos el experimento de la papaya y en este a pesar de seguir correctamente los pasos, no produjo, energía, es decir la papaya no nos sirvió como conductor de electricidad .
- El material o elemento que mas conduce electricidad es el NaCl
- El clip que se encontraba conectado al lado negativo de la pila produjo burbujas .
PARTE # 2
EXPERIMENTO ( REACCIONES DE OXIDO - REDUCCIÓN Y CELDAS ELECTROLÍTICAS)
OBJETIVO GENERAL :
* Construir una pila casera
OBJETIVO ESPECIFICO:
* Emplear la pila casera para hacer funcionar un dispositivo electrónico de baja potencia.
MATERIALES
- 4 Alambres de cobre
- 10 Ganchos clip
- 1 Led ( diodo emisor de luz)
- 1 Limón
- 1 Papaya pequeña
- 1 Vaso de precipitados de 100 ml
REACTIVOS
- 2 Laminas de cobre de 4 cm de longitud y 1 cm de ancho
- 2 Laminas de zinc de las mismas medidas
- Solución de HCl 0,1 M
FUNDAMENTACION TEÓRICA
Se denomina reacción de reducción-oxidación, de óxido-reducción o, simplemente, reacción redox, a toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.1
Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte:
- El agente oxidante es aquel elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
- El agente reductor Es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir siendo oxidado.2
Cuando un elemento químico reductor cede electrones al medio, se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un «par redox». Análogamente, se dice que, cuando un elemento químico capta electrones del medio, este se convierte en un elemento reducido, e igualmente forma un par redox con su precursor oxidado. Cuando una especie puede oxidarse, y a la vez reducirse, se le denomina anfolito, y al proceso de la oxidación-reducción de esta especie se le llama anfolización.
DIAGRAMA DE FLUJO
DISCUSIÓN DE RESULTADOS
1 ¿ Porque la papaya y el limón funcionan como celdas electrolíticos?
Una de sus razones es por el ácido que contiene cada uno por los iones en el jugo.
2 ¿ Que reacciones ocurren en el cátodo y en el ánodo?
Cátodo: Es un electrodo con carga negativa que sufre una reaccion de reduccion mediante la cual un material reduce su estado de oxidación al recibir electrones.
Ánodo: Es un electrodo en el cual se produce una reaccion de oxidación mediante la cual un material al perder electrones incrementa su estado de oxidación
3 ¿ Como puedes hacer una apreciación cuantitativa de la energía eléctrica producida en este proceso?
Esto se puede cuantificar mediante un conducto metro que tiene el pHimetro en el laboratorio y también por el tiempo que permanece.
4 ¿ Porque algunas reacciones químicas generan energía eléctrica?
Porque son exotermicas.
CONCLUSIONES
- Es importante saber que las frutas son fuente de energía independientemente si a la hora de hacer el experimento funciona o no como lo son la papaya y el limón
- Se debe tener en cuenta que cada circuito que se hace debe ser todo proporcional .
ELABORACIÓN GALLETAS CASERAS
PRACTICA # 16
PRESENTADO POR : GRUPO: # 2
GALLETAS CASERAS
OBJETIVO GENERAL
Elaborar galletas caseras.
OBJETIVOS ESPECÍFICOS:
° Dar un valor agregado a las galletas caseras
° Lograr un buen sabor y presentación
MATERIALES
- Harina
- Mantequilla
- Polvo para hornear
- Azúcar
- Esencia de caramelo
- Huevos
- Chispas de chocolate
- Leche personal
FUNDAMENTACION TEÓRICA
La galleta es un producto alimenticio pequeño y plano, dulce, horneado hecho normalmente a base de harina, huevos, azúcar, y/o mantequilla, aceite de cocina u otro aceite o grasa. Puede incluir otros ingredientes como pasas, avena, virutas de chocolate o nueces.
las galletas caseras principalmente la de chispas de chocolate es una galleta que se origino en los estados unidos con chispas de chocolate como ingrediente distintivo.
La receta tradicional combina una masa a base de mantequilla y azúcar con chispas de chocolate semi- dulces.
Las galletas, se comercializan prácticamente de todos los colores y sabores y es que las galletas son todo un clásico de la repostería. cuentan hoy por hoy con mil y una variantes de : frutas, frutos secos, de nata de café, de mantequilla, rellenas, cubiertas de azúcar de colores, galletas " saladas".
Delicia irresistible para los mas golosos, especialmente si son elaboradas de forma casera.
Las galletas caseras son una autentica delicia, incluso para los paladares mas exigentes, existen una multitud de recetas pero tu eres quien te encargas de darle el toque secreto.
PROCEDIMIENTO
- en un bol mezclar muy bien la mantequilla con el azúcar ( hasta que no se sientan grumos)
- Agregar las yemas de huevo y la media cucharadita de esencia
- Agregar la harina y el polvo de hornear tamizados a la preparación anterior
- mezclar bien
- agregar una cucharadita de leche liquida
- Agregar las chispas de chocolate ( Revolver muy bien )
- armar las galletas
- rociarle un poco de azúcar por encima
- Hornear por 10 o 15 mint a temp de 180°c.
DIAGRAMA DE FLUJO

RESULTADOS
Se obtuvieron unas galletas muy rica con un buen sabor, planteadas en el diagrama de flujo y fundamentación teórica con una consistencia un poco cremosa y con un sabor exquisito para nuestro gusto del grupo.
DISCUSIÓN DE RESULTADOS
Comparando los resultados con la fundamentación teórica y diagrama de flujo y pues vinos que obtuvimos el producto esperado logrando mezclar todos los ingredientes necesarios para la preparación de las galletas dio un sabor muy rico no tan simple ni tan dulce.
La cantidad para preparar las galletas fue de un kilo de harina de trigo y nos salio 120 galletas en donde nos rindió mucho los ingredientes y que no es tantas complicaciones en la elaboracion
Es importante no aplicar tanto polvo para hornear para que no se expandan tanto la galletas ni tomen una contextura gruesa
Al momento de hornear no colocar las galletas tan juntas ya que se pueden pegar y no salir nada
COSTOS DE PRODUCCIÓN
* Harina ................................................. 2 tazas $ 2600
* Azúcar ................................................ 1/2 taza $ 1500
* Huevos ............................................ 2 $ 600
* Mantequilla .............................. 125g $ 2400
* Polvo para hornear ............................ 1 cdts $ 800
* Leche ................................................ 3 cdts $ 700
* chispas de colores ........................... $ 5000
* Esencia de vainilla ........................... 1/2 cda $ 1800
CONCLUSIONES
-Quedamos muy satisfechos con los resultados que obtuvimos de las galletas ya que tanto al grupo como a las demás personas les gustaron
-nos dios la contextura necesaria para la elaboración de las galletas
-puedes acompañarlas con un vaso de leche a su gusto
BIBLIOGRAFIA
- http://www.gastrocronicas.com/2010/03/galletas-con-chispas-de-chocolate.html
- http://www.hogarmania.com/cocina/recetas/postres/201211/recetas-para-hacer-galletas-caseras-17443.html
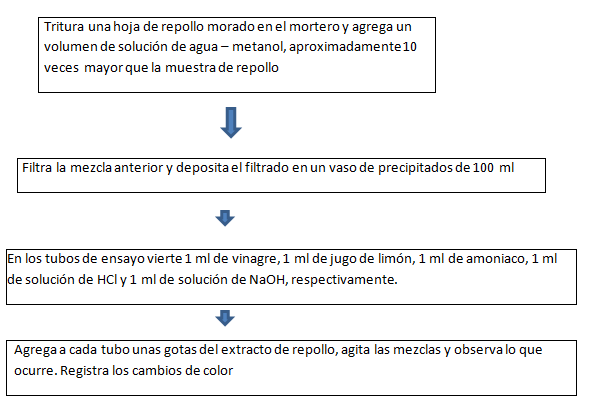
ELABORACIÓN DE UN INDICADOR DE PH
PRACTICA # 15
PRESENTADO POR : GRUPO: # 2
INDICADORES DE PH
OBJETIVO GENERAL:
* Elaborar un indicador de pH a partir del repollo morado
OBJETIVO ESPECIFICO:
* Determinar cada uno de los grados de las diferentes soluciones
MATERIALES
FUNDAMENTACION TEÓRICA
Un indicador es sustancia natural o sintética que cambia de color en respuesta a la naturaleza de su medio químico. Los indicadores se utilizan para obtener información sobre el grado de acidez o pH de una sustancia, o sobre el estado de una reacción química en una disolución que se está valorando o analizando. Uno de los indicadores más antiguos es el tornasol (el papel tornasol rojo se vuelve azul cuando se humedece con una solución básica; el papel tornasol azul se vuelve rojo al humedecerse con una solución ácida), un tinte vegetal que adquiere color rojo en las disoluciones ácidas y azul en las básicas. Otros indicadores son la alizarina, el rojo de metilo y la fenolftaleína; cada uno de ellos es útil en un intervalo particular de acidez o para un cierto tipo de reacción química. Los indicadores pueden ser naturales o artificiales.
DIAGRAMA DE FLUJO
DISCUSIÓN DE RESULTADOS
1 ¿Cuales de las sustancias utilizadas son ácidas?
°Repollo morado: es una planta de la familia del repollo (y ambas de las coles). Es una variedad de col en la que las hojas poseen un color violáceo característico. su color se debe a la presencia de un pigmento llamado antocianina. La fuerza de este color puede depender en gran medida de la acidez (pH) del suelo, las hojas crecen más rojas en suelos de carácter ácido mientras que en los alcalinos son más azules.
5 ¿ Que otros vegetales se pueden utilizar para elaborar indicadores de pH?
Las charconas y auronas viran de amarillo a rojo ; las flaconas e isoflavonas varían de diversos tonos de rojo. Los flavoles de cafe a anaranjado . Anticioninas - azul
Los flavonoides pigmentos vegetales que toman color amarillo en presencia de vapores de amoniaco ( Pétalos blanco - flores)
RESULTADOS
Tubo 1 : ( HCl)
Al agregarle las 10 gotas de metanol se separo un momento del NaOH y con la sustancia de repollo morado se obtuvo un color lila .
Tubo 2: (Agua oxigenada)
Al agregarle el zumo de repollo no se nota cambio y con las gotas de etanol tampoco
Tubo 3: ( NaOH)
Con el zumo dio un color azul claro y con el metanol no se noto ningún cambio
Tubo 4: (Vinagre)
Con las gotas de metanol tomo un color rosado claro y con el zumo nada
Tubo 5: ( Limón)
Con el zumo de repollo dio un color lila mas fuerte.
CONCLUSIONES
PRACTICA # 15
PRESENTADO POR : GRUPO: # 2
INDICADORES DE PH
OBJETIVO GENERAL:
* Elaborar un indicador de pH a partir del repollo morado
OBJETIVO ESPECIFICO:
* Determinar cada uno de los grados de las diferentes soluciones
MATERIALES
- Hojas de repolllo morado
- Jugo de limon
- Papel filtro
- Montaje para filtracion simple
- 1 Mortero con pistilo
- 1 Vaso de precipitados de 100ml
- 5 Tubos de ensayo
- 1 Gradilla
- 1 Gotero
- 1 Pipeta graduada de 1 ml
REACTIVOS
- Amoniaco NH3
- sln de Acido Clorhidrico HCl
- sln deHidroxido de sodio, NaOH
- Metano CH3OH
- Vinagre diluido CH3COOh
Un indicador es sustancia natural o sintética que cambia de color en respuesta a la naturaleza de su medio químico. Los indicadores se utilizan para obtener información sobre el grado de acidez o pH de una sustancia, o sobre el estado de una reacción química en una disolución que se está valorando o analizando. Uno de los indicadores más antiguos es el tornasol (el papel tornasol rojo se vuelve azul cuando se humedece con una solución básica; el papel tornasol azul se vuelve rojo al humedecerse con una solución ácida), un tinte vegetal que adquiere color rojo en las disoluciones ácidas y azul en las básicas. Otros indicadores son la alizarina, el rojo de metilo y la fenolftaleína; cada uno de ellos es útil en un intervalo particular de acidez o para un cierto tipo de reacción química. Los indicadores pueden ser naturales o artificiales.
En la tabla se muestran algunos indicadores ácido-base, o de pH, con sus intervalos de viraje (intervalos de pH en los que cambian de color) y sus distintos colores según se encuentren en medio ácido o básico:
Nombre de la
Sustancia
|
Intervalo
de pH
|
Color del
Ácido
|
Color de
La Base
|
| Azul de bromofenol | 3,0 - 4,6 | Amarillo | Púrpura |
| Anaranjado de metilo | 3.1-4.4 | Rojo | Amarillo |
| Rojo de metilo | 4.2-6.2 | Rojo | Amarillo |
| Azul de bromotimol | 6.0-7.6 | Amarillo | Azul |
| Tornasol | 5.8-8.0 | Rojo | Azul |
| Fenolftaleína | 8.0-9.8 | Incoloro | Rojo – Violeta |
| Amarillo de alizarina | 10.1-12.0 | Amarillo | Violeta |
DIAGRAMA DE FLUJO
DISCUSIÓN DE RESULTADOS
1 ¿Cuales de las sustancias utilizadas son ácidas?
- Limón
- Vinagre
- HCl
2 ¿ Cuales de las sustancias utilizadas son básicas?
- NaOH
3 ¿ Que coloraciones toma el repollo en presencia de ácidos y bases?
- Lila
- Blanco
- Azul claro
- Rosado claro
- Rosada fuerte
4 ¿ Porque la solución de repollo morado se puede considerar un indicador ácido - base?
°Repollo morado: es una planta de la familia del repollo (y ambas de las coles). Es una variedad de col en la que las hojas poseen un color violáceo característico. su color se debe a la presencia de un pigmento llamado antocianina. La fuerza de este color puede depender en gran medida de la acidez (pH) del suelo, las hojas crecen más rojas en suelos de carácter ácido mientras que en los alcalinos son más azules.
5 ¿ Que otros vegetales se pueden utilizar para elaborar indicadores de pH?
Las charconas y auronas viran de amarillo a rojo ; las flaconas e isoflavonas varían de diversos tonos de rojo. Los flavoles de cafe a anaranjado . Anticioninas - azul
Los flavonoides pigmentos vegetales que toman color amarillo en presencia de vapores de amoniaco ( Pétalos blanco - flores)
RESULTADOS
Tubo 1 : ( HCl)
Al agregarle las 10 gotas de metanol se separo un momento del NaOH y con la sustancia de repollo morado se obtuvo un color lila .
Tubo 2: (Agua oxigenada)
Al agregarle el zumo de repollo no se nota cambio y con las gotas de etanol tampoco
Tubo 3: ( NaOH)
Con el zumo dio un color azul claro y con el metanol no se noto ningún cambio
Tubo 4: (Vinagre)
Con las gotas de metanol tomo un color rosado claro y con el zumo nada
Tubo 5: ( Limón)
Con el zumo de repollo dio un color lila mas fuerte.
CONCLUSIONES
- Aprendimos a elaborar un indicador de pH a partir del repollo morado en el cual determinamos algunos cambios con diferentes químicos.
- Se utilizan como indicador de las sustancias químicas que cambian su color al cambiar el pH de la solución .
Suscribirse a:
Comentarios (Atom)